Средний риск хромосомной патологии плода. Анализ крови на хромосомную патологию плода у беременных. Дети с хромосомной патологией
Хромосомные болезни, или синдромы - это группа врожденных патологических состояний, проявляющихся множественными пороками развития, различающихся по своей клинической картине, часто сопровождающихся тяжелыми нарушениями психического и соматического развития. Основной дефект - различные степени интеллектуальной недостаточности, что может осложняться нарушениями зрения, слуха, опорно-двигательного аппарата, более выраженными, чем интеллектуальный дефект, расстройствами речи, эмоциональной сферы и поведения.
Диагностические признаки хромосомных синдромов можно разделить на три группы:
неспецифические, т.е. такие, как выраженная умственная отсталость, сочетающаяся с дисплазиями, врожденными пороками развития и черепно-лицевыми аномалиями;
признаки, характерные для отдельных синдромов;
патогномоничные для конкретного синдрома, например, специфический плач при синдроме «кошачьего крика».
Хромосомные заболевания не подчиняются менделеевским закономерностям передачи заболевания потомству и в большинстве случаев обнаруживаются спорадически, являясь следствием мутации в половой клетке одного из родителей.
Хромосомные болезни могут быть унаследованы, если мутация имеется во всех клетках родительского организма.
К механизмам, лежащим в основе геномных мутаций, относятся:
нерасхождение - хромосомы, которые должны были разделяться во время клеточного деления, остаются соединенными и относятся к одному полюсу;
«анафазное отставание» - утрата отдельной хромосомы (моносомия) может иметь место во время анафазы, когда одна хромосома может отстать от остальных;
полиплоидизация - в каждой клетке геном представлен более чем дважды.
Факторы, повышающие риск рождения детей с хромосомными болезнями
Причины возникновения хромосомных болезней до настоящего времени недостаточно изучены. Имеются экспериментальные данные о влиянии на мутационный процесс таких факторов, как: действие ионизирующих излучении, химических веществ, вирусов. Другими причинами нерасхождения хромосом могут быть: сезонность, возраст отца и матери, порядок рождения детей, прием лекарств во время беременности, гормональные нарушения, алкоголизм и др. Не исключается до определенной степени и генетическое детерминирование нерасхождения хромосом. Повторим, однако, что причины образования геномных и хромосомных мутаций на ранних стадиях развития зародыша до сих пор окончательно не раскрыты.
К биологическим факторам повышения риска рождения детей с хромосомными аномалиями может быть отнесен возраст матери. Риск рождения больного ребенка особенно резко возрастает после 35 лет. Это характерно для любых хромосомных болезней, но наиболее четко наблюдается для болезни Дауна.
В медико-генетическом планировании беременности особое значение уделяется двум факторам - наличию анеуплоидии по аутосомам у ребенка и возрасту матери старше 35 лет.
К кариотипическим факторам риска у супружеских пар относятся: анеуплоидия (чаще в мозаичной форме), робертсоновские транслокации (слияние двух телоцентрических хромосом в области деления) кольцевые хромосомы, инверсии. Степень повышения риска зависит от типа хромосомных нарушений.



Синдром Дауна (трисомия по 21 паре хромосом)
Причина: Нерасхождение 21 пары аутосом, транслокация 21 аутосомы на аутосому группы D или G. У 94% кариотип - 47 хромосом. Частота проявления синдрома увеличивается с возрастом матери.
Клиника: Признаки, позволяющие диагностировать заболевание, в типичных случаях выявляются на самых ранних этапах жизни ребенка. Малый рост ребенка, маленькая круглая голова со скошенным затылком, своеобразное лицо - бедная мимика, косой разрез глаз со складкой у внутреннего угла, нос с широкой плоской переносицей, маленькие деформированные ушные раковины. Рот обычно полуоткрыт, язык толстый, неповоротливый, нижняя челюсть иногда выступает вперед. На щеках часто отмечается сухая экзема. Обнаруживается укорочение конечностей, особенно в дистальных отделах. Кисть плоская, пальцы рук широкие, короткие. В физическом развитии отстают, однако не резко, но нервно-психическое развитие замедленно (плохо развита речь). С возрастом выявляется ряд новых черт заболевания. Голос грубеет, отмечается близорукость, косоглазие, конъюнктивиты, неправильный рост зубов, кариес.Слабо развита иммунная система, инфекционные заболевания протекают крайне тяжело и в 15 раз чаще, чем у других детей. Встречается острый лейкоз.
Патогенез: Патологии внутренних органов, сердечно-сосудистые дефекты.
Диагностика: Клиническое обследование, подтверждаемое цитогенетическим анализом кариотипа.
Лечение: Комплексная терапия, включающая правильную организацию режима, рационально построенная медико-педагогическая работа, лечебная физкультура, массаж, медикаментозное лечение.


Синдром Тернера-Шершевского (ХО)
Причина: Нерасхождение половых хромосом, отсутствие одной Х-хромосомы, кариотип - 45 хромосом.
Клиника : Низкий рост,непропорциональное строение тела, полная короткая шея с крыловидными кожными складками, широкая грудная клетка, Х-образное искривление коленей. Уши деморфированы, низко расположены. Отмечается неправильный рост зубов. Половой инфантилизм. Снижение умственного развития.
Патогенез: В пубертатный период недоразвитие половых органов и вторичных половых признаков, поражение сосудистой системы, аномалии мочевой системы, уменьшение остроты зрения, слуха.
Диагностика : У новорожденных ее установить трудно. С возрастом диагностика основывается на клинической картине и определении патологии кариотипа и полового хроматина.
Лечение: Симптоматическое, направленное на увеличение роста. Для увеличения роста используются анаболические гормоны. С 13-15 лет начинают лечение эстрогенными препаратами. Полного выздоровления не наблюдается, однако лечебные мероприятия могут улучшить состояние


Синдром Клайнфельтера (XXY ; XYY ; XYYYY ; XXXY )
Причина: Нерасхождение половых хромосом, вследствие чего увеличивается число X или Y хромосом в клетке, кариотип - 47 (XXY), 48 и более хромосом.
Клиника: Высокий рост, отсутствие залысин на лбу, плохой рост бороды, гинекомастия, остеохондроз, бесплодие, слаборазвиты мышцы, аномалия зубов и костной системы. Больные могут демонстрировать сниженный интеллект. С увеличением X-хромосом увеличивается умственная отсталость до полной идиотии, с увеличением Y-хромосом - агрессивность. Больные с более глубокой степенью интеллектуального дефекта могут обнаруживать ряд психопатологических признаков: они мнительны, склонны к алкоголизму, способны совершать различные правонарушения.
Патогенез: В пубертатном периоде обнаруживается недоразвитие первичных половых признаков.
Диагностика: Основана на клинических данных, а также на определении патологического кариотипа цитогенетическим методом, что подтверждается исследованием полового хроматина в клетках.
Лечение: Терапия с помощью мужских половых гормонов для увеличения потенции. Психотерапия.

Синдром Волъфа-Хиршхорна
Причина: У 80 % страдающих им новорожденных цитологическую основу данного синдрома составляет деления короткого плеча 4-й хромосомы. Размеры делеции колеблются от небольших терминальных до занимающих около половины дистальной части короткого плеча. Отмечается, что большинство делеции возникает заново, около 13 % происходит, в результате транслокаций у родителей. Реже в геноме больных, помимо траснлокации, имеются и кольцевые хромосомы. Наряду с делениями хромосом, патология у новорожденных может быть обусловлена инверсиями, дупликациями, изохромосомами.
Клиника: У новорожденных небольшой вес при нормальной продолжительности беременности. Также отмечаются микроцефалия, клювовидный нос, эпикант, антимонголоидный разрез глаз (опущение наружных углов глазных щелей), аномальные ушные раковины, расщелина верхней губы и неба, маленький рот, деформация стоп и др. Дети с синдромом Вольфа-Хиршхорна маложизнеспособны, как правило умирают в возрасте до одного года.
Патогенез: Болезнь характеризуется многочисленными врожденными пороками развития, задержкой умственного и психомоторного развития.
Диагностика: По клинической картине.
Лечение: Не существует.
Синдром трисомии (XXX )
Причина: Нерасхождение половых хромосом в результате нарушения работы митотического веретена деления во время мейоза, кариотип - 47 хромосом.
Клиника: Пузырное нерасхождение плаценты; новорожденный имеет небольшой, широкий задний родничок, недоразвитые затылочные и теменные кости черепа. Отставание в развитии на 6-7 месяцев. Низко расположены деформированные ушные раковины. Синдактилия пальцев кисти, расщелина губы и неба, гидроцефалия. Многие женщины нормально развиты, интеллект ниже среднего. Частота развития шизофреноподобных психозов увеличивается второе.
Патогенез: Пороки развития внутренних органов.
Диагностика: По клинической картине и цитогенетическому определению патологии кариотипа и полового хроматина.
Лечение: Симптоматическое.

Синдром Эдвардса (трисомия по 18 паре хромосом)
Причина: Нерасхождение аутосом на стадии гамет (иногда зигот). Лишняя хромосома в 18 паре. Кариотип 47, Е18+. Выражена зависимость частоты рождения больных детей от возраста родителей.
Клиника: Пренатальное недоразвитие, слабая активность плода, нарушения строения лица (короткие глазные щели, маленькая верхняя челюсть) и костно-мышечной системы практически постоянны. Ушные раковины деформированы и в подавляющем большинстве случаев расположены низко. Грудина короткая, ядра окостенения расположены неправильно и в меньшем количестве. Спинномозговые грыжи и расщелины губ.
Патогенез: Наиболее постоянны пороки сердца и крупных сосудов. Нарушения развития головного мозга, в основном гипоплазия мозжечка и мозолистого тела. Из пороков глаз чаще всего обнаруживается микроанафтольмия. Врожденное отсутствие щитовидной железы и надпочечников.
Диагностика: Клинический осмотр, дерматоглифика,
цитогенетическое обследование.
Лечение: Отсутствует, 90% детей умирают на первом году жизни. Выжившие дети умирают от инфекционных заболеваний, чаще от пневмонии.


Синдром Патау (трисомия но 13 таре аутосом)
Причина: Нерасхождение аутосом 13 пары в гаметогенезе у одного из родителей. Кариотип - 47, D13+ .
Клиника: Аномалии черепа и лица, окружность черепа обычно уменьшена, в ряде случаев имеется выраженная тригоноцефалия. Умеренная микроцефалия сочетается со сравнительно низким и скошенным лбом, узкими глазными щелями, запавшим предносьем с широким основанием носа, низко расположенными и деформированными ушными раковинами. Расстояние между глазными щелями часто уменьшено. На коже головы имеются дефекты скальпа овальной или круглой формы. Часто – заячья губа и волчья пасть. Аномалии костно-мышечной системы, полидактилия.
Патогенез: Смертность в течение первого года жизни (90%). Основной причиной смерти детей являются тяжелые, несовместимые с жизнью пороки развития: дефекты сердечно-сосудистой и мочеполовой систем, аномалии толстой кишки, пупочная грыжа, нарушения строения глазных яблок, постоянны микроанофтальмия, дисплазия сетчатки, катаракты. Врожденные пороки сердца встречаются у 80% детей.
Диагностика: Основана на клиническом, цитогенетическим исследованиях.

Синдром "кошачьего крика"
Причина: Делеция короткого плеча хромосомы 5-й пары. Кариотип 46, 5р-.
Клиника: Патологическое строение голосовых связок - сужение, мягкость хрящей, отечность и необычная складчатость слизистой, мяуканье кошки. Недоразвитие речи. Микроцефалия. Лунообразное лицо, монголоидный разрез глаз, косоглазие, катаракта, атрофия зрительного нерва, плоская спинка носа, высокое нёбо, деформированные ушные раковины. Косолапость. Задержка умственного и физического развития. Продолжительность жизни значительно снижена, только около 14% больных переживают возраст 10 лет.
Патогенез: Порок сердца.
Диагностика: Клиническое обследование с выявлением наиболее постоянного признака синдрома - "кошачий крик", дерматоглифика и цитогенетическое выявление патологии кариотипа.
Лечение: Отсутствует.

Синдром Орбели
Причина : Деления длинного плеча аутосомы 13.
Клиника: Лоб переходит в нос, не образуя носовой вырезки. Большое расстояние между глазами. Широкая спинка носа, высокое нёбо, низко расположенные диспластичные ушные раковины, пороки развития глаз (косоглазие, катаракта). Пороки опорно-двигательного аппарата -неспецифические аномалии (косолапость, вывих тазобедренных суставов). Задержка роста и психомоторного развития; характерна глубокая олигофрения. Больные с развернутой клинической картиной синдрома погибают на первом году жизни.
Патогенез: Аномальное развитие практически всех органов и систем; микроцефалия; врожденные пороки сердца и аномалии прямой кишки.
Диагностика:
Лечение: Отсутствует.
Синдром Мориса
Причина: Мутация гена, нарушающая образование нормального белка - рецептора, делает ткани-мишени невосприимчивому гормону, направляющему их развитие по мужскому типу. Не использовав такую возможность на определенном этапе онтогенеза, организм осуществляет развитие по женскому типу.
Клиника: Появляется особь с кариотипом XY, но внешне более сходна с женщиной. Такие субъекты не способны иметь потомство, так как их половые железы (семенники) недоразвиты, а их выводные протоки часто формируются по женскому типу (недоразвитая матка, влагалище). Вторичные половые признаки также характерны для женского пола.
Патогенез: Недоразвитые половые органы.
Диагностика: Цитогенетическое, клиническое обследование.
Лечение: Гормональная терапия.

Частота врожденных пороков развития составляет 2-3%, еще 5% новорожденных имеют так называемые малые аномалии. Причинные факторы их являются гетерогенными и включают хромосомные аномалии, моногенные заболевания, влияние тератогенов, материнские заболевания (инсулинзависимый сахарный диабет, фенилкетонурия), инфекции (краснуха, цитомегалия и др). Но большинство врожденных аномалий развития является мультифакториальными, т.е. зависят от комбинации генетических факторов и воздействия агрессивных факторов внешней среды.
Что такое пренатальный скрининг
Пренатальный скрининг, диагностика и лечение является относительно новой проблемой в акушерстве. Началом пренатального скрининга была, возможно, эра ультразвуковой диагностики в акушерстве, которая началась около двух десятилетий назад. С открытием новых генов и их фенотипов становится все более возможным пренатальный генетический диагноз. Следует различать понятия скрининга и диагностики.
Пренатальный скрининг позволяет выявить индивидов высокого риска осложнений среди популяции индивидов с низким риском осложнений. Специфичность и чувствительность скрининговых тестов очень важны, учитывая возможность ложноположительных и ложноотрицательных результатов скрининга.
Пренатальная диагностика, конечно, более специфическая, чем скрининг (например, амниоцентез или биопсия хориона), но имеет и больший риск осложнений. Первым шагом по определению риска для плода является скрининг матери о наличии определенных состояний или заболеваний.
Нередко возникает вопрос о вероятности роста частоты у потомков семейных пар, которые получали лечение по поводу бесплодия. Тяжелая олигоспермия и азооспермия ассоциируются со сбалансированными транслокациями хромосом (3-5%), синдромом Кляйнфельтера (47, ХХУ), аномалиями и микроделеции У-хромосомы.
Аномалии Х-хромосомы (ХХУ, ХХХ, Х-мозаицизм при синдроме Тернера) ассоциируются с пониженной фертильностью (субфертильностью), а также увеличением риска хромосомных аномалий у потомков. В 2/3 пациентов с врожденным отсутствием семявыносящих протоков имеет место хотя бы одна мутация гена, который отвечает за развитие кистозного фиброза. Итак, эти пациенты подлежат скринингу на наличие кистозного фиброза. Таким пациентам обычно показана интрацитоплазматическая инъекция сперматозоида в яйцеклетку, хотя наличие мутантного гена по кистозному фиброзу может влиять на репродуктивные намерения.
Хромосомные аномалии
Старший возраст матери является фактором риска хромосомных аномалий в связи с увеличением возможности нерасхождения хромосом в процессе мейоза. Фертилизация гаметы с одной лишней хромосомой приводит к образованию продукта оплодотворения с 47 хромосомами. Следовательно, растет частота анеуплоидии — количества хромосом в продукте оплодотворения, большей или меньшей 46. Нерасхождение хромосом может иметь место в аутосомах (трисомия 21, 13, 18) или половых хромосомах (моносомия 45, Х, или трисомия 47, ХVV, 47, ХХХ и др). Несбалансированные транслокации хромосом сопровождаются аномальным количеством хромосомного материала (целой хромосомы или ее части). Риск для ребенка зависит от типа транслокации.
Факторы риска рождения детей с хромосомными аномалиями
- Возраст матери 35 лет и старше
- Рождение детей с хромосомными аномалиями в анамнезе
- Хромосомные аномалии у родителей, включая сбалансированные транслокации, анеуплоидии, мозаицизм
- Хромосомные аномалии у близких родственников
- Аномальные результаты ультразвуковой анатомии плода
- Аномальные результаты сывороточных скрининговых тестов / аномальный тройной тест (АФП, эстриол)
- Рождение детей с пороками нервной трубки в анамнезе
Частота хромосомных аномалий у живых новорожденных составляет 0,5%, у мертворожденных — 5%, у абортусов при самопроизвольных выкидышах — 50%. Частой хромосомной аномалией является анеуплоидия — увеличение или недостаток одной хромосомы. У рожденных живыми наиболее часто встречаются такие хромосомные аномалии, как трисомия 21 (1: 800), трисомия 18 и трисомия 13.
Трисомия 16 наиболее часто приводит к самопроизвольным выкидышам, а в случае трисомии 18 в большинстве случаев имеет место мертворождение. При наличии в анамнезе трисомии у плода риск рецидива при повторной беременности составляет 1%. В случае триплоидии обычно имеет место самопроизвольный аборт или гестационная трофобластическая болезнь. В редких случаях ребенок может родиться с триплоидией, но продолжительность жизни не превышает 1 года.
Хромосомные аномалии часто сопровождаются выраженными фенотипическими проявлениями и врожденными пороками развития, хотя их не всегда можно обнаружить при ультразвуковом скрининге.
Наиболее точным методом диагностики хромосомных аномалий является исследование кариотипа плода. Для некоторых хромосомных синдромов (синдром Дауна) существуют скрининговые тесты, например тройной тест:
1) уровень а-фетопротеина;
3) уровень в-субъединицы ХГЧ в сыворотке крови матери.
Синдром Дауна
Скрининг на генетические заболевания
Сегодня известно более 11 000 моногенных заболеваний, которые кодируются одним геном (генетически обусловленные) и передаются от родителей их потомкам. Механизм передачи многих генетических болезней объясняется принципами Менделя.
Аутосомно-доминантные моногенные синдромы встречаются с частотой 1: 200 индивидов; заболевание наблюдается у многих поколений, передается потомкам и рецидивирует с частотой 50%. Примерами аутосомно-доминантных моногенных расстройств могут быть:
- ахондроплазия,
- нейрофиброматоз,
- синдром Марфана,
- болезнь Хантингтона,
- семейный полипоз.
Появление аутосомно-доминантных заболеваний у новорожденных от «здоровых» родителей может быть обусловлено следующими причинами:
1. Мозаицизм зародышевых клеток. Мутация может иметь место лишь в популяции зародышевых клеток. Итак, родители являются непораженными, но могут передавать мутацию потомкам.
2. Новые мутации. Рост возраста родителей ассоциируется с увеличением риска аутосомно-доминантных расстройств (ахондроплазии, танатофорной дисплазии, нейрофиброматоза, синдрома Аперта — краниосиностоз). Риск рецидивов у других детей не увеличивается.
3. Вариабельна экспрессия. Тяжесть заболевания может варьировать, и родители могут не распознать мягкие и субклинические мутации.
4. Уменьшенная пенетрантность. Родители могут иметь аномальный ген без клинических проявлений заболевания.
5. Неверное отцовство. Частота неверного отцовства достигает 15%.
Аутосомно-рецессивные моногенные заболевания проявляются в многочисленных родственников при наличии двух пораженных аллелей. Если оба родителя являются носителями пораженного гена, риск заболевания у потомства равен 25% при каждой беременности. Аутосомно-рецессивные заболевания включают кистозный фиброз, серповидно-клеточную анемию, фенилкетонурию, болезнь Тея-Сакса, Канавана и др.
При Х-сцепленных рецессивных синдромах (гемофилия и др.) мать-носитель пораженного гена передает его своим сыновьям. Итак, 50% сыновей могут быть больными и 50% дочерей будут носителями этого гена. Редкие Х-доминантные синдромы могут передаваться от каждого родителя каждому ребенку подобно аутосомно-доминантных синдромов. Фенотип может сильно варьировать, что связано со смешанной пенетрантностью, лионизацией (гетерохроматизацией) Х-хромосомы (синдром ломкой Х-хромосомы) и геномным импринтингом.
Экспансия тринуклеотидных повторов. Некоторые гены содержат участки тройных повторов (например, ССС). Такие участки являются нестабильными и могут увеличиваться в следующих генерациях, этот феномен получил название антиципации. Количество повторений определяет степень поражения индивида. Экспансия тринуклеотидных повторов составляет основу многочисленных генетических расстройств, таких как синдром ломкой (фрагильной) Х-хромосомы, миотоническая дистрофия и болезнь Хантингтона.
Синдром ломкой (фрагильной) Х-хромосомы является наиболее частой причиной семейной задержки умственного развития. Пораженные мужчины имеют типичные черты: большие уши, выступающая челюсть, большие яички, аутичное поведение, легкая или умеренная умственная отсталость. Женщины обычно менее поражены в связи с инактивацией Х-хромосомы.
Ген ломкой Х-хромосомы локализуется в Х-хромосоме и имеет три нуклеотидные повтора (ССС). Нормальные индивиды имеют 6-50 повторов, непораженные носители женского пола могут иметь 50-200 повторов, которые могут распространяться на мейоза до полной мутации при наличии более 200 повторов. Если имеет место полная мутация, ген инактивируется путем метилирования; плод будет пораженным. Тяжесть заболевания зависит от степени Х-инактивации у женщин, степени метилирования и мозаицизма размера повторов.
Женщины-носители премутации имеют 50%-й риск передачи гена с экспансией. Мужчины с премутациею фенотипически являются нормальными, но все их дочери будут носителями премутации. В случае трансмиссии мужчинам количество повторов остается стабильным. Тест на ломку Х-хромосому выполняется с целью выявления количества повторов и степени метилирования.
Показания для тестирования на ломкую Х-хромосому
- Индивиды с задержкой умственного и общего развития, аутизмом
- Индивиды с чертами фрагильной Х-хромосомы
- Индивиды с наличием синдрома фрагильной Х-хромосомы в семейном анамнезе
- Индивиды с наличием в семейном анамнезе недиагностированной задержки умственного развития
- Плоды от матерей-носителей
Геномный
импринтинг
— процесс, при котором активация гена происходит преимущественно в материнской или преимущественно в родительской хромосоме, но не в обеих хромосомах. Нормальное развитие имеет место лишь в том случае, если присутствуют обе копии (материнская и отцовская) импринтинг-ген. Импринтинг-ген неактивен, значит, активный ген теряет (путем делеции) или получает мутацию, в таком случае плод будет пораженным. Лишь несколько генов могут испытывать импринтинга.
Примерами геномного импринтинга может быть синдром Ангельмана и полный пузырный занос (вариант гестационной трофобластической болезни).
Синдром Ангельмана характеризуется тяжелой задержкой умственного развития, атаксической походкой, типичным лицом, пароксизмами смеха и судорогами. Ген синдрома Ангельмана является активным только в материнской унаследованной хромосоме, следовательно, если происходит делеция материнской хромосомы 15 или материнская копия гена имеет мутацию, белковый продукт не образуется и плод будет пораженным.
Синдром Ангельмана также может развиться, если обе копии хромосомы 15 является унаследованными от отца (отсутствие материнской копии хромосомы 15). Это состояние получило название унипарентальной дисомии. Унипарентальная дисомия возникает чаще вследствие потери хромосомы у эмбриона с трисомией или добавления хромосомы у плода с моносомией по этой хромосомой. Каждая из хромосом может быть генетически различной (гетеродисомия) или идентичной (изодисомия), в зависимости от времени возникновения этого феномена — в течение первого или второго мейотического деления, соответственно.
Полный пузырный занос обычно является диплоидным (46, ХХ или Х ¥), но может иметь полностью отцовское происхождение, без материнского хромосомного материала. При таких условиях плод не может развиваться. Полный пузырный занос может сопровождать нормальную многоплодную беременность, но в этом случае возрастает риск материнских осложнений (гипертиреоидизм, преэклампсия, преждевременные роды). В отличие от полного пузырного заноса, частичный пузырный занос обычно является триплоидным (69, ХХХ, 69, ХVV), с дополнительным набором отцовских хромосом.
Триплоидия с дополнительным набором материнских хромосом имеет место при ЗВУР плода, врожденных пороках развития и маленькой плаценте.
Митохондриальное наследование
Митохондрии в цитоплазме яйцеклетки (но не сперматозоида) передаются от матери к ее потомкам. Митохондрия имеет собственную ДНК. Существует несколько генетических заболеваний, вызванных мутациями митохондриальной ДНК, — наследственная оптическая нейропатия Лебера, болезнь Ли (подострая некротизирующая энцефаломиелопатия), миоклоническая эпилепсия с «зазубренными красными волокнами». Экспрессия этих заболеваний является вариабельной.
Организм человека является сложной системой, деятельность которой регулируется на различных уровнях. При этом определенные вещества должны участвовать в конкретных биохимических процессах, чтобы все клетки, органы и целые системы могли правильно функционировать. А для этого требуется заложить правильное основание. Подобно тому, как многоэтажный дом не выстоит без соответствующим образом подготовленного фундамента, «здание» человеческого тела требует корректной передачи наследственного материала. Именно заложенный в нем генетический код управляет развитием зародыша, позволяет сформироваться всем взаимодействиям и обуславливает нормальное существование человека.
Однако в некоторых случаях в наследственной информации появляются ошибки. Они могут возникать на уровне отдельных генов или же касаться их крупных объединений. Подобные изменения называются генными мутациями. В отдельных ситуациях проблема относится к целым хромосомам, то есть к структурным единицам клетки. Соответственно, их называют хромосомными мутациями. Наследственные болезни, развивающиеся вследствие нарушений хромосомного набора или строения хромосом, получили название хромосомных.
В норме каждая клетка организма содержит одно и то же количество хромосом, объединенных в пары с одинаковыми генами. У человека полный набор состоит из 23 пар, и только в половых клетках вместо 46 хромосом находится половинное число. Это необходимо для того, чтобы в процессе оплодотворения при слиянии сперматозоида и яйцеклетки получилась полноценная комбинация со всеми необходимыми генами. Гены распределены по хромосомам не случайно, а в строго определенном порядке. При этом линейная последовательность сохраняется одинаковой для всех людей.
Однако в процессе образования половых клеток могут произойти различные «ошибки». В результате мутаций изменяется количество хромосом или их структура. По этой причине после оплодотворения в яйцеклетке может оказаться избыточное или, напротив, недостаточное количество хромосомного материала. Из-за дисбаланса процесс развития зародыша нарушается, что может привести к самопроизвольному прерыванию беременности, рождению мертвого ребенка либо развитию наследственного хромосомного заболевания.
Этиология хромосомных заболеваний
К этиологическим факторам хромосомных патологий относятся все разновидности хромосомных мутаций. Кроме того, некоторые геномные мутации также способны оказывать подобное действие.
У человека встречаются делеции, дупликации, транслокации и инверсии, то есть все типы мутаций. При делеции и дупликации генетическая информация оказывается в недостаточном и избыточном количестве соответственно. Поскольку современными методами можно выявить отсутствие даже небольшой части генетического материала (на уровне гена), то провести четкую границу между генными и хромосомными заболеваниями практически невозможно.
Транслокации представляют собой обмен генетическим материалом, который происходит между отдельными хромосомами. Иными словами, происходит перемещение участка генетической последовательности на негомологичную хромосому. Среди транслокаций выделяют две важные группы – реципрокные и Робертсоновские.
Транслокации реципрокного характера без потери задействованных участков называются сбалансированными. Они, как и инверсии, не вызывают потери генной информации, поэтому не приводят к паталогическим эффектам. Тем не менее, при дальнейшем участии таких хромосом в процессе кроссинговера и редукции могут образовываться гаметы с несбалансированными наборами, обладающие недостаточным набором генов. Их участие в процессе оплодотворения приводит к тому, что у потомства развиваются те или иные наследственные синдромы.
Для Робертсоновских транслокаций характерно участие двух акроцентрических хромосом. В ходе процесса короткие плечи утрачиваются, а длинные сохраняются. Из 2 исходных хромосом формируется одна цельная, метацентрическая. Несмотря на потерю части генетического материала развития патологий в таком случае обычно не происходит, поскольку функции утраченных участков компенсируются аналогичными генами в остальных 8 акроцентрических хромосомах.
При концевых делециях (то есть при их утрате) может сформироваться кольцевая хромосома. У ее носителя, получившего такой генный материал от одного из родителей, отмечают частичную моносомию по концевым участкам. При разрыве через центромеру может сформироваться изохромосома, имеющая одинаковые по набору генов плечи (у обычной хромосомы они отличаются).
В некоторых случаях может развиваться однородительская дисомия. Она возникает, если при нерасхождении хромосом и оплодотворении возникнет трисомия, а после этого одна из трех хромосом будет удалена. Механизм этого явления в настоящее время не изучен. Однако в результате в хромосомном наборе появится две копии хромосомы одного родителя, в то время как часть генной информации от второго родителя будет утеряна.
Многообразие вариантов искажения хромосомного набора обуславливает различные формы заболеваний.

Имеется три базовых принципа, которые позволяют точно классифицировать возникшую хромосомную патологию. Их соблюдение обеспечивает однозначное указание на форму отклонения.
Согласно первому принципу необходимо определить характеристику мутации, генной или хромосомной, причем требуется также четко указать конкретную хромосому. К примеру, это может быть простая трисомия по 21 хромосоме или триплоидия. Сочетание индивидуальной хромосомы и типа мутации определяет формы хромосомной патологии. Благодаря соблюдению этого принципа можно точно установить, в какой структурной единице имеются изменения, а также выяснить, зафиксирован избыток или недостаток хромосомного материала. Такой подход более эффективен, чем классификация по клиническим признакам, поскольку многие отклонения вызывают сходные нарушения развития организма.
Согласно второму принципу нужно определить тип клеток, в котором произошла мутация – зигота или гамета. Мутации в гаметах приводят к появлению полных форм хромосомного заболевания. В каждой клетке организма будет содержаться копия генетического материала с хромосомной аномалией. Если же нарушение происходит позднее, на этапе зиготы или во время дробления, то мутация классифицируется как соматическая. В этом случае часть клеток получает изначальный генетический материал, а часть – с измененным хромосомным набором. Одновременно в организме может присутствовать два и более типа наборов. Их сочетание напоминает мозаику, поэтому такая форма болезни называется мозаичной. Если в организме присутствует более 10% клеток с измененным хромосомным набором, клиническая картина повторяет полную форму.
Согласно третьему принципу выявляется поколение, в котором мутация появилась первый раз. Если изменение было отмечено в гаметах здоровых родителей, то говорят о спорадическом случае. Если же оно уже имелось в материнском или отцовском организме, то речь идет о наследуемой форме. Значительная часть унаследованных хромосомных заболеваний вызывается робертсоновскими транслокациями, инверсиями и сбалансированными реципрокными транслокациями. В процессе мейоза они могут привести к образованию патологической комбинации.
Полная точная диагностика подразумевает, что установлены тип мутации, затронутая хромосома, выяснен полный или мозаичный характер заболевания, а также установлена передача по наследству или спорадическое возникновение. Получить необходимые для этого данные можно при проведении генетической диагностики с использованием проб пациента, а в некоторых случаях и его родственников.
Общие вопросы
Интенсивное развитие генетики в течение последних десятилетий позволило развить отдельное направление хромосомной патологии, которая постепенно приобретает все большое значение. К этой области относятся не только хромосомные болезни, но и различные нарушения во время внутриутробного развития (к примеру, выкидыши). В настоящее время счет аномалий идет уже на 1000. Свыше ста форм характеризуются клинически очерченной картиной и называются синдромами.
Выделяется несколько групп болезней. Триплоидией называется случай, при котором в клетках организма имеется лишняя копия генома. Если же появился дубликат только одной хромосомы, то подобное заболевание называется трисомией. Также причинами аномального развития организма могут быть делеции (удаленные участки генетического кода), дупликации (соответственно, лишние копии генов или их групп) и иные дефекты. Английский врач Л. Даун в 1866 году описал одну из самых известных болезней такого рода. Синдром, получивший его имя, развивается при наличии лишней копии 21 хромосомы (трисомия-21). Трисомии по другим хромосомам, как правило, заканчиваются выкидышами или приводят к смерти в детском возрасте из-за серьезных нарушений в развитии.
Позже были открыты случаи моносомии по X-хромосоме. В 1925 году Шерешевский Н.А и в 1938 году Тернер Г. описали его симптомы. Трисомия-XXY, которая встречается у мужчин, была описана Клайнфельтером в 1942 году.
Указанные случаи заболеваний стали первыми объектами исследований в этой области. После того, как расшифровали этиологию трех перечисленных синдромов, фактически появилось направление хромосомных болезней. В течение 60-х годов дальнейшие цитогенетические исследования привели к формированию клинической цитогенетики. Ученые доказали связь между патологическими отклонениями и хромосомными мутациями, а также получили статистические данные о частоте появления мутаций у новорожденных и в случаях самопроизвольного прерывания беременности.
Типы хромосомных аномалий
Хромосомные аномалии могут быть как относительно крупными, так и небольшими. В зависимости от их размеров меняются методы исследования. К примеру, для точечных мутаций, делеций и дупликаций, касающихся участков длиной в сотню нуклеотидов, обнаружение при помощи микроскопа невозможно. Определить хромосомное нарушение при помощи метода дифференциального окрашивания возможно только в том случае, если величина затронутого участка исчисляется в миллионах нуклеотидов. Небольшие мутации можно выявить лишь при помощи установления нуклеотидной последовательности. Как правило, большие по размерам нарушения (к примеру, видимые в микроскоп) приводят к более выраженному воздействию на функционирование организма. Кроме того, аномалия может затрагивать не только ген, но и участок наследственного материала, функции которого в настоящее время не исследованы.
Моносомией называется аномалия, выражающаяся в отсутствии одной из хромосом. Обратным случаем является трисомия – добавление лишней копии хромосомы к стандартному набору из 23 пар. Соответственно, меняется и число копий генов, которые в норме присутствуют в двух экземплярах. При моносомии отмечается нехватка гена, при трисомии – его избыток. Если хромосомная аномалия приводит к изменению числа отдельных участков, то говорят о частичной трисомии или моносомии (к примеру, по плечу 13q).
Известны также случаи однородительской дисомии. При этом пара гомологичных хромосом (либо одна и часть гомологичной ей) попадает в организм от одного из родителей. Причиной является неизученный механизм, предположительно состоящий из двух фаз – образование трисомии и удаление одной из трех хромосом. Воздействие однородительской дисомии может быть как незначительным, там и заметным. Дело в том, что если в одинаковых хромосомах имеется рецессивный мутантный аллель, то он автоматически проявляется. В то же время родитель, от которого была получена хромосома с мутацией, из-за гетерозиготности по гену может не иметь проблем со здоровьем.
Из-за высокой важности генетического материала для всех этапов развития организма даже небольшие аномалии могут вызвать серьезные изменения в скоординированной деятельности генов. Ведь их совместная работа шлифовалась в течение миллионов лет эволюции. Неудивительно, что последствия от возникновения такой мутации, скорее всего, начинают проявляться уже на уровне гамет. Особенно сильно они влияют на мужчин, поскольку зародыш в определенный момент должен перейти с женского пути развития на мужской. Если же активности соответствующих генов недостаточно, возникают различные отклонения, вплоть до гермафродитизма.

Первые исследования эффектов от хромосомных нарушений стали проводить в 60-х годах, после того как был установлен хромосомный характер некоторых заболеваний. Можно условно выделить две большие группы связанных эффектов: врожденные пороки развития и изменения, вызывающие летальные исходы. Современная наука располагает сведениями, что хромосомные аномалии начинают проявляться уже на стадии зиготы. Летальные эффекты при этом являются одной из основных причин гибели плода в утробе (этот показатель у человека достаточно высок).
Хромосомные аберрации – это изменение структуры хромосомного материала. Они могут как возникать спорадически, так и передаваться по наследству. Точная причина, по которой они появляются, не установлена. Ученые полагают, что за некоторую часть таких мутаций отвечают различные факторы окружающей среды (например, химически активные вещества), которые воздействуют на эмбрион или даже на зиготу. Интересен тот факт, что большая часть хромосомных аберраций обычно связана с хромосомами, которые зародыш получает от отца.
Значительная часть хромосомных аберраций встречается очень редко и была обнаружена один раз. В то же время некоторые другие достаточно часто встречаются, причем даже у людей, не связанных родственными узами. К примеру, широко распространена транслокация центромерных или близких к ним районов 13 и 14 хромосом. Утрата неактивного хроматина коротких плеч практически не влияет на состояние здоровья. При аналогичных робертсоновских транслокациях в кариотип попадает 45 хромосом.
Примерно две трети всех обнаруживаемых у новорожденных хромосомных аномалий компенсируются за счет других копий генов. По этой причине они не несут серьезной угрозы нормальному развитию ребенка. Если же компенсация нарушения невозможна, возникают пороки развития. Часто такая несбалансированная аномалия выявляется у больных с умственной отсталостью и другими врожденными пороками, а также у плода после самопроизвольных абортов.
Известны компенсированные аномалии, которые способны наследоваться из поколения в поколение без возникновения заболеваний. В некоторых случаях такая аномалия может перейти в несбалансированную форму. Так, если имеется транслокация, затрагивающая 21 хромосому, возрастает риск трисомии по ней. По статистике такие транслокации имеются у каждого 20 ребенка, у которого зафиксирована трисомия-21, причем в каждом пятом случае аналогичное нарушение есть у одного из родителей. Поскольку большая часть детей с вызванной транслокацией трисомией-21 рождается у молодых (менее 30 лет) мам, то в случае обнаружения этого заболевания у ребенка необходимо произвести диагностическое обследование молодых родителей.
Риск появления нарушений, которые не компенсируются, сильно зависит от транслокации, поэтому теоретические расчеты затруднены. Тем не менее, приблизительно определить вероятность соответствующей патологии можно на основании статистических данных. Такая информация собрана для распространенных транслокаций. В частности, робертсоновская транслокация между 14 и 21 хромосомами у матери с вероятностью 2 процента приводит к трисомии-21 у ребенка. Эта же транслокация у отца передается по наследству с вероятностью 10%.
Распространенность хромосомных аномалий
Результаты исследований показывают, что как минимум десятая часть яйцеклеток после оплодотворения и около 5-6 процентов плодов имеют различные хромосомные аномалии. Как правило, на 8-11 неделе в таком случае происходит самопроизвольное прерывание беременности. В некоторых случаях они вызывают более поздние выкидыши или приводят к рождению мертвого ребенка.
У новорожденных (по результатам обследования более 65 тысяч детей) изменение числа хромосом либо значительные хромосомные аберрации встречаются примерно у 0,5% от общего количества. Как минимум каждый 700-й имеет трисомию по 13, 18 или 21 хромосоме; около 1 из 350 мальчиков имеют расширенный до 47 единиц набор хромосом (кариотипы 47,XYY и 47,XXY). Моносомия по X-хромосоме встречается реже – единичные случаи на несколько тысяч. Порядка 0,2% имеют компенсированные хромосомные аберрации.
У взрослых иногда также выявляются наследуемые отклонения (как правило, компенсированные), иногда с трисомией по половым хромосомам. Исследования также показывают, что примерно 10-15 процентов от общего числа случаев умственной отсталости могут быть объяснены наличием хромосомной аномалии. Этот показатель значительно возрастает, если вместе с нарушениями умственного развития наблюдаются анатомические дефекты. Бесплодие также часто вызывается лишней половой хромосомой (у мужчин) и моносомией/аберрацией по X хромосоме (у женщин).
Связь хромосомных аномалий и злокачественных образований
Как правило, исследование клеток злокачественных новообразований приводит к обнаружению видимых в микроскоп хромосомных аномалий. Сходные результаты дает проверка при лейкозе, лимфоме и ряде других заболеваний.
В частности, для лимфом нередким случаем является обнаружение транслокации, сопровождающейся разрывом внутри или рядом с локусом тяжелой цепи иммуноглобулина (14 хромосома). При этом ген MYC перемещается с 8 хромосомы на 14.
Для миелолейкоза в большинстве случаев (свыше 95%) фиксируется транслокация между 22 и 9 хромосомами, вызывающая появление характерной «филадельфийской» хромосомы.
Бластный криз в процессе развития сопровождается появлением в кариотипе последовательных хромосомных аномалий.
Методами дифференциального окрашивания с последующим наблюдением в микроскоп, а также при помощи молекулярно-генетических способов тестирования, можно своевременно выявлять хромосомные аномалии при различных лейкозах. Эта информация помогает сделать прогноз развития, по ней уточняется диагноз и корректируется терапия.
Для распространенных солидных опухолей, таких, как рак толстой кишки, рак молочной железы и т.д. обычные цитогенетические методы применимы с некоторыми ограничениям. Тем не менее, характерные для них хромосомные аномалии также были выявлены. Имеющиеся в опухолях отклонения часто связаны с генами, отвечающими за процесс нормального роста клеток. Из-за амплификации (образования множественных копий) гена иногда отмечается формирование мелких мини-хромосом в клетках новообразований.
В некоторых случаях появление злокачественного образования вызывает потеря гена, который должен обеспечивать подавление пролиферации. Причин может быть несколько: делеции и разрыв в процессе транслокации являются наиболее частыми. Мутации такого рода принято считать рецессивными, поскольку наличие даже одной нормальной аллели обычно обеспечивает достаточный контроль роста. Нарушения могут появляться или наследоваться. Если же в геноме отсутствует нормальная копия гена, то пролиферация перестает зависеть от регулирующих факторов.
Таким образом, наиболее значимыми хромосомными аномалиями, влияющими на возникновение и рост злокачественных новообразований, являются следующие типы:
Транслокации, поскольку они могут привести к нарушению нормального функционирования генов, отвечающих за пролиферацию (либо вызвать их усиленную работу);
Делеции, которые наряду с прочими рецессивными мутациями вызывают изменения в процессе регуляции роста клетки;
Рецессивные мутации, из-за рекомбинации становящиеся гомозиготными и оттого проявляющиеся в полной мере;
Амплификации, стимулирующие пролиферацию клеток опухоли.
Выявление указанных мутаций в ходе генетической диагностики может указывать на повышенный риск развития злокачественных новообразований.
Известные заболевания хромосомной природы
Одним из самых известных заболеваний, происходящих по причине наличия аномалий в генетическом материале, является синдром Дауна. Он обуславливается трисомией по 21 хромосоме. Характерным признаком этой болезни является отставание в развитии. Дети испытывают серьезные проблемы во время обучения в школе, часто им требуется альтернативная методика преподавания материала. Вместе с тем отмечаются нарушения физического развития – плоское лицо, увеличенные глаза, клинодактилия и другие. Если такие люди прикладывают значительные усилия, они могут достаточно хорошо социализироваться, известен даже случай успешного получения высшего образования мужчиной с синдромом Дауна. У больных повышен риск заболеть деменцией. Это и ряд других причин приводит к небольшой продолжительности жизни.
К трисомии относится и синдром Патау, только в этом случае имеется три копии 13 хромосомы. Для заболевания характерны множественные пороки развития, часто с полидактилией. В большинстве случаев отмечается нарушение деятельности центральной нервной системы либо ее неразвитость. Часто (примерно в 80 процентах) больные имеют пороки развития сердца. Тяжелые нарушения приводят к высокой смертности – в первый год жизни умирает до 95% детей с этим диагнозом. Заболевание не поддается лечению или коррекции, как правило, можно лишь обеспечить достаточно постоянный контроль состояния человека.
Еще одна форма трисомии, с которой рождаются дети, относится к 18 хромосоме. Заболевание в этом случае носит название синдрома Эдвардса и характеризуется множественными нарушениями. Деформируются кости, часто наблюдается измененная форма черепа. Сердечно-сосудистая система обычно с пороками развития, также проблемы отмечаются с органами дыхания. В результате около 60% детей не доживают до 3 месяцев, к 1 году умирает до 95% детей с этим диагнозом.
Трисомия по другим хромосомам у новорожденных практически не встречается, поскольку почти всегда приводит к преждевременному прерыванию беременности. В части случаев рождается мертвый ребенок.
С нарушениями числа половых хромосом связан синдром Шерешевского-Тернера. Из-за нарушений в процессе расхождения хромосом теряется X-хромосома в женском организме. В результате организм не получает должного количества гормонов, поэтому нарушается его развитие. В первую очередь это относится к половым органам, которые развиваются лишь отчасти. Практически всегда для женщины это обозначает невозможность иметь детей.
У мужчин полисомия по Y или X хромосоме приводит к развитию синдрома Клайнфельтера. Для этого заболевания характерна слабая выраженность мужских признаков. Зачастую сопровождается гинекомастией, возможно отставание в развитии. В большинстве случаев наблюдаются ранние проблемы с потенцией и бесплодие. В этом случае, как и для синдрома Шерешевского-Тернера, выходом может стать экстракорпоральное оплодотворение.
Благодаря методам пренатальной диагностики стало возможным выявление этих и других заболеваний у плода во время беременности. Семейные пары могут принять решение о прерывании беременности, чтобы попробовать зачать другого ребенка. Если же они принимают решение выносить и родить малыша, то знание особенностей его генетического материала позволяет заранее подготовиться к определенным методам профилактики или лечения.
Кариотип – систематизированный набор хромосом ядра клетки с его количественными и качественными характеристиками.

Нормальный женский кариотип - 46,XX Нормальный мужской кариотип - 46,XY
Исследование кариотипа - процедура, призванная выявить отклонения структуры строения и числа хромосом.
Показания для кариотипирования:
- Множественные врожденные пороки развития, сопровождаемые клинически анормальным фенотипом или дизморфизмом
- Умственная отсталость или отставание в развитии
- Нарушение половой дифференцировки или аномалии полового развития
- Первичная или вторичная аменорея
- Аномалии спермограммы – азооспермия или тяжелая олигоспермия
- Бесплодие неясной этиологии
- Привычное невынашивание
- Родители пациента со структурными хромосомными аномалиями
- Повторное рождение детей с хромосомными аномалиями
К сожалению, с помощью исследования кариотипа можно определить лишь крупные структурные перестройки. В большинстве же случаев аномалии строения хромосом представляют собой микроделеции и микродупликации невидимые под микроскопом. Однако такие изменения хорошо идентифицируются современными молекулярными цитогенетическими методами - флуоресцентной гибридизацией (FISH) и хромосомным микроматричным анализом.
Аббревиатура FISH расшифровывается как fluorescent in situ hybridization – флуоресцентная гибридизация на месте. Это цитогенетический метод, который применяют для выявления и определения положения специфической последовательности ДНК на хромосомах. Для этого используют специальные зонды - нуклеозиды, соединенные с флуорофорами или некоторыми другими метками. Визуализацию связавшихся ДНК-зондов проводят при помощи флуоресцентного микроскопа.
Метод FISH позволяет изучать небольшие хромосомные перестройки, которые не идентифицируются при стандартном исследовании кариотипа. Однако, имеет один существенный недостаток. Зонды являются специфичными только к одному участку генома и, как следствие, при одном исследовании можно определить наличие или число копий только этого участка (или нескольких при использовании многоцветных зондов). Поэтому важным является правильная клиническая предпосылка, а FISH анализ может только подтвердить иди не подтвердить диагноз.
Альтернативой этому методу является хромосомный микроматричный анализ, который при такой же точности, чувствительности и специфичности определяет количество генетического материала в сотнях тысяч (и даже миллионах) точек генома, что дает возможность диагностики практически всех известных микроделеционных и микродупликационных сииндромов.

Хромосомный микроматричный анализ – молекулярно-цитогенетический метод для выявления вариаций числа копий ДНК по сравнению с контрольным образцом. При выполнении этого анализа исследу¬ются все клинически значимые участки генома, что позволяет с максимальной точностью исключить хромосомную патологию у обследуемого. Таким образом могут быть выявлены патогенные деле¬ции (исчезновение участков хромосом), дупликации (появление дополни¬тельных копий генетического материала), участки с потерей гетерозиготности, которые имеют важное значение при болезнях импринтинга, близкородственных браках, аутосомно-рецессивных заболеваниях.
Когда необходим хромосомный микроматричный анализ
- В качестве теста первой линии для диагностики пациентов с дизморфиями, врожденными пороками развития, умственной отсталостью/задержкой развития, множественными врожденными аномалиями, аутизмом, судорогами или любым подозрением на наличие геномного дисбаланса.
- В качестве замены кариотипа, FISH и сравнительной геномной гибридизации, если подозревается микроделеционный/микродупликационный синдром.
- В качестве исследования для выявления несбалансированных хромосомных аберраций.
- В качестве дополнительного диагностического исследования при моногенных заболеваниях, связанных с функциональной потерей одного аллеля (гаплонедостаточностью), особенно если при секвенировании не удается выявить патогенную мутацию, и делеция всего гена может быть причиной.
- Для определения происхождения генетического материала при однородительских дисомиях, дупликациях, делециях.
1 тест - 400 синдромов (список)
Введение в хромосомный микроматричный анализ.
Информация для врачей
Правила забора материала для хромосомного микроматричного анализа
Наличие идеальных анализов и замечательное самочувствие беременной, ее юный возраст и безупречный анамнез (информация о перенесенных заболеваниях, условиях жизни, операция, травмах, хронической патологии, наследственности и под.) еще не являются 100% гарантией, что у ребенка нет хромосомных аномалии.
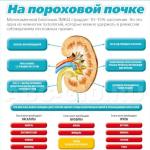
Хромосомные аномалии плода. Признаки
Признаки наличия хромосомной аномалии (ХА) плода во время беременности:
- угроза выкидыша или, как минимум, тянущие боли внизу живота с ранних сроков беременности и на протяжении всей беременности,
- низкий уровень АФП и РАРР-А и повышение ХГЧ на сроке ,
- шейная плода складка более 2 мм на сроке ,
- малая активность плода (шевеления),
- увеличение лоханок почек по УЗИ на сроках ,
- отставание роста трубчатых костей, начиная с ,
- ранее старение плаценты,
- гипоплазия плаценты,
- гипоксия плода,
- плохие показатели допплерометрии и КТГ,
- маловодие/ многоводие.
Каждый из этих признаков в отдельности и даже все вместе могут быть вариантами нормы.
Диагностика ХА
Из обычных анализов наиболее информативен первый скрининг или двойной тест. Его надо делать строго на сроке . Он состоит из УЗИ плода (особенно важен замер шейной складки) и анализа крови на АФП, РАРР-А и ХГЧ.
Анализ не дает точного ответа на вопрос о наличии или отсутствии ХА. Его задача — рассчитать риски в зависимости от результатов, а также возраста и анамнеза беременной. Второй скрининг, так называемый "тройной тест", не информативен для выявления ХА. Узнать точно, есть ли у будущего ребенка ХА, можно только при помощи инвазивных методов — биопсии хориона, забора пуповинной крови, анализа амниотической жидкости. Цель этих анализов — определение кариотипа плода. Точность — 98%. Риск выкидыша — 1-2%. ХА не лечатся. После выявления ХА все, что может предложить медицина, — прерывание беременности.
Делать этот анализ или нет?
При принятии решения необходимо ответить на следующие вопросы:
- не превышает ли риск выкидыша риск наличия ХА у плода?
- будете ли вы прерывать беременность в случае выявления ХА?
- какую ХА подозревают врачи, какой прогноз для здоровья ребенка?
- готовы ли вы к рождению ребенка с ХА?
Причины возникновения хромосомных аномалий
Однозначных причин возникновения ХА не известно. Повышенный риск существует, если:
- возраст матери и отца превышает 35 лет,
- есть ХА у кровных родственников,
- есть сбалансированная транслокация у кровных родственников или у родителей,
- родители работают на вредных производствах, семья проживает в экологически неблагополучном районе.
Механизм возникновения ХА
ХА возникает у плода в момент образования зиготы, т.е. при слиянии яйцеклетки и сперматозоида. Материнская и отцовская клетка несут по 23 хромосомы (23 от мамы и 23 от папы). Обе клетки могут уже нести в себе "ломаные" хромосомы (даже если мама и папа абсолютно здоровы). Сбой может произойти и в момент слияния двух абсолютно здоровых родительских клеток. В этом случае "расходятся" неверно хромосомы плода. Этот процесс еще не изучен и не поддается контролю.
ХА — хромосомные синдромы
Изучено и описано более 300 хромосомных синдромов.
Учитывая, что у человека 23 парных хромосомы и существует несколько видов аберрации, количество хромосомных синдромов, не описанных в литературе и возникающих вновь, не ограничено.
Аберрации могут быть разные: полные и частичные трисомии, делеции, моносомии, мозаицизм транслокации и т.д. Выраженность признаков при хромосомном синдроме зависит от вида аберрации. Самый благоприятный вид — сбалансированная транслокация. Люди с такими изменениями ничем не отличаются от обычных, их особенность может быть выявлена только путем кариотипирования, однако у них повышен риск рождения детей с хромосомными синдромами — от 10 до 50% (средний риск в популяции — 5%).
Следующий наименее "травматичный" вид аберрации — мозаицизм, при котором хромосомное нарушение проявляется не во всех клетках и/или органах. Частичные трисомии и делеции дают уже значительные пороки развития, порой не совместимые с жизнью.
Самый тяжелый вид — полная трисомия или моносомия хромосомы.
Большая часть беременностей с хромосомной патологией плода отторгается самим организмом на самых ранних сроках или на сроке 20-23 недели, так как при хромосомной патологии плода велика вероятность различных патологий беременности (невынашивание, угроза выкидыша, гипертонус матки, преждевременное старение плаценты, токсикоз, гестоз, гипоксия плода и т.д.). Также многие малыши не доживают до года ввиду множественных пороков развития. Средняя продолжительность жизни людей с ХА — 30 лет, но есть описанные случаи пациентов с ХА доживших до 60 лет и более.
Развитие людей с ХА
Люди с хромосомными синдромами могут быть как тяжелыми инвалидами, так и абсолютно полноценными членами общества, получившими полноценное образование и имеющими обычную работу. Все зависит от вида аберрации, общего состояния организма и труда родных и близких. В большинстве случаев люди с хромосомными синдромами могут себя обслуживать, общаться, выполнять посильную работу. Интеллект снижен, есть хронические заболевания органов и систем организма.
Руководитель направления
„Онкогенетика“
Жусина
Юлия Геннадьевна

Окончила педиатрический факультет Воронежского государственного медицинского университета им. Н.Н. Бурденко в 2014 году.
2015 - интернатура по терапии на базе кафедры факультетской терапии ВГМУ им. Н.Н. Бурденко.
2015 - сертификационный курс по специальности «Гематология» на базе Гематологического научного центра г. Москвы.
2015-2016 – врач терапевт ВГКБСМП №1.
2016 - утверждена тема диссертации на соискание ученой степени кандидата медицинских наук «изучение клинического течения заболевания и прогноза у больных хронической обструктивной болезнью легких с анемическим синдромом». Соавтор более 10 печатных работ. Участник научно-практических конференций по генетике и онкологии.
2017 - курс повышения квалификации по теме: «интерпретация результатов генетических исследований у больных с наследственными заболеваниями».
С 2017 года ординатура по специальности «Генетика» на базе РМАНПО.
Руководитель направления
„Генетика“
Канивец
Илья Вячеславович

Канивец Илья Вячеславович, врач-генетик, кандидат медицинских наук, руководитель отдела генетики медико-генетического центра Геномед. Ассистент кафедры медицинской генетики Российской медицинской академии непрерывного профессионального образования.
Окончил лечебный факультет Московского государственного медико-стоматологического университета в 2009 году, а в 2011 – ординатуру по специальности «Генетика» на кафедре Медицинской генетики того же университета. В 2017 году защитил диссертацию на соискание ученой степени кандидата медицинских наук на тему: Молекулярная диагностика вариаций числа копий участков ДНК (CNVs) у детей с врожденными пороками развития, аномалиями фенотипа и/или умственной отсталостью при использовании SNP олигонуклеотидных микроматриц высокой плотности»
C 2011-2017 работал врачом-генетиком в Детской клинической больнице им. Н.Ф. Филатова, научно-консультативном отделе ФГБНУ «Медико-генетический научный центр». С 2014 года по настоящее время руководит отделом генетики МГЦ Геномед.
Основные направления деятельности: диагностика и ведение пациентов с наследственными заболеваниями и врожденными пороками развития, эпилепсией, медико-генетическое консультирование семей, в которых родился ребенок с наследственной патологией или пороками развития, пренатальная диагностика. В процессе консультации проводится анализ клинических данных и генеалогии для определения клинической гипотезы и необходимого объема генетического тестирования. По результатам обследования проводится интерпретация данных и разъяснение полученной информации консультирующимся.
Является одним из основателей проекта «Школа Генетики». Регулярно выступает с докладами на конференциях. Читает лекции для врачей генетиков, неврологов и акушеров-гинекологов, а также для родителей пациентов с наследственными заболеваниями. Является автором и соавтором более 20 статей и обзоров в российских и зарубежных журналах.
Область профессиональных интересов – внедрение современных полногеномных исследований в клиническую практику, интерпретация их результатов.
Время приема: СР, ПТ 16-19
Руководитель направления
„Неврология“
Шарков
Артем Алексеевич
Шарков Артём Алексеевич – врач-невролог, эпилептолог
В 2012 году обучался по международной программе “Oriental medicine” в университете Daegu Haanu в Южной Корее.
С 2012 года - участие в организации базы данных и алгоритма для интерпретации генетических тестов xGenCloud (http://www.xgencloud.com/, Руководитель проекта - Игорь Угаров)
В 2013 году окончил Педиатрический факультет Российского национального исследовательского медицинского университета имени Н.И. Пирогова.
C 2013 по 2015 год обучался в клинической ординатуре по неврологии в ФГБНУ «Научный центр неврологии».
С 2015 года работает неврологом, научным сотрудником в Научно- исследовательском клиническом институте педиатрии имени академика Ю.Е. Вельтищева ГБОУ ВПО РНИМУ им. Н.И. Пирогова. Также работает врачом- неврологом и врачом лаборатории видео-ЭЭГ мониторинга в клиниках «Центр эпилептологии и неврологии им. А.А.Казаряна» и «Эпилепси-центр».
В 2015 году прошел обучение в Италии на школе «2nd International Residential Course on Drug Resistant Epilepsies, ILAE, 2015».
В 2015 году повышение квалификации - «Клиническая и молекулярная генетика для практикующих врачей», РДКБ, РОСНАНО.
В 2016 году повышение квалификации - «Основы молекулярной генетики» под руководством биоинформатика, к.б.н. Коновалова Ф.А.
С 2016 года - руководитель неврологического направления лаборатории "Геномед".
В 2016 году прошел обучение в Италии на школе «San Servolo international advanced course: Brain Exploration and Epilepsy Surger, ILAE, 2016».
В 2016 году повышение квалификации - "Инновационные генетические технологии для врачей", "Институт лабораторной медицины".
В 2017 году – школа «NGS в медицинской генетике 2017», МГНЦ
В настоящее время проводит научные исследования в области генетики эпилепсии под руководством профессора, д.м.н. Белоусовой Е.Д. и профессора, д.м.н. Дадали Е.Л.
Утверждена тема диссертации на соискание ученой степени кандидата медицинских наук "Клинико-генетические характеристики моногенных вариантов ранних эпилептических энцефалопатий".
Основные направления деятельности – диагностика и лечение эпилепсии у детей и взрослых. Узкая специализация – хирургическое лечение эпилепсии, генетика эпилепсий. Нейрогенетика.
Научные публикации
Шарков А., Шаркова И., Головтеев А., Угаров И. «Оптимизация
дифференциальной диагностики и интерпретации результатов генетического
тестирования экспертной системой XGenCloud при некоторых формах
эпилепсий». Медицинская генетика, № 4, 2015, с. 41.
*
Шарков А.А., Воробьев А.Н., Троицкий А.А., Савкина И.С., Дорофеева
М.Ю., Меликян А.Г., Головтеев А.Л. "Хирургия эпилепсии при многоочаговом
поражении головного мозга у детей с туберозным
склерозом." Тезисы XIV Российского Конгресса «ИННОВАЦИОННЫЕ
ТЕХНОЛОГИИ В ПЕДИАТРИИ И ДЕТСКОЙ ХИРУРГИИ». Российский
Вестник Перинатологии и Педиатрии, 4, 2015. - с.226-227.
*
Дадали Е.Л., Белоусова Е.Д., Шарков А.А. "Молекулярно-генетические подходы к
диагностике моногенных идиопатических и симптоматических
эпилепсий". Тезис XIV Российского Конгресса «ИННОВАЦИОННЫЕ
ТЕХНОЛОГИИ В ПЕДИАТРИИ И ДЕТСКОЙ ХИРУРГИИ». Российский
Вестник Перинатологии и Педиатрии, 4, 2015. - с.221.
*
Шарков А.А., Дадали Е.Л., Шаркова И.В. «Редкий вариант ранней эпилептической
энцефалопатии 2 типа, обусловленной мутациями в гене CDKL5 у больного
мужского пола». Конференция "Эпилептология в системе нейронаук". Сборник
материалов конференции: / Под редакцией: проф. Незнанова Н.Г., проф.
Михайлова В.А. СПб.: 2015. – с. 210-212.
*
Дадали Е.Л., Шарков А.А., Канивец И.В., Гундорова П., Фоминых
В.В., Шаркова И,В,. Троицкий А.А., Головтеев А.Л., Поляков А.В. Новый
аллельный вариант миоклонус-эпилепсии 3 типа, обусловленный мутациями в
гене KCTD7// Медицинская генетика.-2015.- т.14.-№9.- с.44-47
*
Дадали Е.Л., Шаркова И.В., Шарков А.А., Акимова И.А. «Клинико-генетические
особенности и современные способы диагностики наследственных эпилепсий».
Сборник материалов «Молекулярно-биологические технологии в медицинской
практике» / Под ред. чл.-корр. РАЕН А.Б. Масленникова.- Вып. 24.-
Новосибирск: Академиздат, 2016.- 262: с. 52-63
*
Белоусова Е.Д., Дорофеева М.Ю., Шарков А.А. Эпилепсия при туберозном
склерозе. В "Болезни мозга, медицинские и социальные аспекты" под редакцией
Гусева Е.И., Гехт А.Б., Москва; 2016; стр.391-399
*
Дадали Е.Л., Шарков А.А., Шаркова И.В., Канивец И.В., Коновалов Ф.А., Акимова
И.А. Наследственные заболевания и синдромы, сопровождающиеся
фебрильными судорогами: клинико-генетические характеристики и способы
диагностики. //Русский Журнал Детской Неврологии.- Т. 11.- №2, с. 33-
41. doi: 10.17650/ 2073-8803- 2016-11- 2-33- 41
*
Шарков А.А., Коновалов Ф.А., Шаркова И.В., Белоусова
Е.Д., Дадали Е.Л. Молекулярно-генетические подходы к диагностике
эпилептических энцефалопатий. Сборник тезисов «VI БАЛТИЙСКИЙ КОНГРЕСС
ПО ДЕТСКОЙ НЕВРОЛОГИИ» / Под редакцией профессора Гузевой В.И. Санкт-
Петербург, 2016, с. 391
*
Гемисферотомии при фармакорезистентной эпилепсии у детей с билатеральным
поражением головного мозга Зубкова Н.С., Алтунина Г.Е., Землянский М.Ю.,
Троицкий А.А., Шарков А.А., Головтеев А.Л. Сборник тезисов «VI БАЛТИЙСКИЙ
КОНГРЕСС ПО ДЕТСКОЙ НЕВРОЛОГИИ» / Под редакцией
профессора Гузевой В.И. Санкт-Петербург, 2016, с. 157.
*
*
Статья: Генетика и дифференцированное лечение ранних эпилептических
энцефалопатий. А.А. Шарков*, И.В. Шаркова, Е.Д. Белоусова, Е.Л. Дадали. Журнал неврологии и психиатрии, 9, 2016; Вып. 2doi: 10.17116/jnevro
20161169267-73
*
Головтеев А.Л., Шарков А.А., Троицкий А.А., Алтунина Г.Е., Землянский М.Ю.,
Копачев Д.Н., Дорофеева М.Ю. "Хирургическое лечение эпилепсии при
туберозном склерозе" под редакцией Дорофеевой М.Ю., Москва; 2017; стр.274
*
Новые международные классификации эпилепсий и эпилептических приступов
Международной Лиги по борьбе с эпилепсией. Журнал неврологии и психиатрии
им. C.C. Корсакова. 2017. Т. 117. № 7. С. 99-106
Руководитель отдела
"Генетика предрасположенностей",
биолог, генетик-консультант
Дудурич
Василиса Валерьевна

– руководитель отдела "Генетика предрасположенностей", биолог, генетик-консультант
В 2010 г – PR-специалист, Дальневосточный институт международных отношений
В 2011 г. – Биолог, Дальневосточный Федеральный Университет
В 2012 г. – ФГБУН НИИ ФХМ ФМБФ России «Генодиагностика в современной медицине»
В 2012 г. – Учеба « Внедрение генетического тестирования в клинику широкого профиля»
В 2012 г. – Профессиональна подготовка «Пренатальная диагностика и генетический паспорт – основа профилактической медицины в век нанотехнологий» НИИ АГ им.Д.И.Отта СЗО РАМН
В 2013 г. – Профессиональна подготовка «Генетика в клинической гемостазиологии и гемореологии» НЦ ССХ им.Бакулева
В 2015 г. – Профессиональна подготовка в рамках VII съезда Российского общества Медицинских генетиков
В 2016 г. – Школа анализа данных «NGS в медицинской практике» ФГБНУ «МГНЦ»
В 2016 г. – Стажировка «Генетическое консультирование» ФГБНУ «МГНЦ»
В 2016 г. – Принимала участие в Международном Конгрессе по Генетике Человека г.Киото, Япония
С 2013-2016 гг – Руководитель медико-генетического центра в г.Хабаровске
С 2015-2016 гг – преподаватель на кафедре "Биологии" в Дальневосточном Государственном Медицинском Университете
С 2016-2018 гг – Секретарь Хабаровского отделения Российского общества медицинских генетиков
В 2018г. – Принимала участие в семинаре "Репродуктивный потенциал России: версии и контрверсии" Сочи, Россия
Организатор школы-семинара «Эпоха генетики и биоинформатики: междисциплинарный подход в науке и практике» - 2013, 2014, 2015, 2016 гг.
Стаж работы генетиком консультантом – 7 лет
Учредитель Благотворительного фонда им.Царицы Александры в помощь детям с генетической патологией alixfond.ru
Сфера профессиональных интересов: миробиом, мультифакториальная патологая, фармакогенетика, нутригенетика, репродуктивная генетика, эпигенетика.
Руководитель направления
"Пренатальная диагностика"
Киевская
Юлия Кирилловна

В 2011 году Окончила Московский Государственный Медико-Стоматологический Университет им. А.И. Евдокимова по специальности «Лечебное дело» Обучалась в ординатуре на кафедре Медицинской генетики того же университета по специальности «Генетика»
В 2015 году окончила интернатуру по специальности Акушерство и Гинекология в Медицинском институте усовершенствования врачей ФГБОУ ВПО «МГУПП»
С 2013 года ведет консультативный прием в ГБУЗ «Центр Планирования Семьи и Репродукции» ДЗМ
С 2017 года является руководителем направления «Пренатальная Диагностика» лаборатории Геномед
Регулярно выступает с докладами на конференциях и семинарах. Читает лекции для врачей различных специальной в области репродуции и пренатальной диагностики
Проводит медико-генетическое консультирование беременных по вопросам пренатальной диагностики с целью предупреждения рождения детей с врождёнными пороками развития, а так же семей с предположительно наследственной или врожденной патологией. Проводит интерпретацию полученных результатов ДНК-диагностики.
СПЕЦИАЛИСТЫ
Латыпов
Артур Шамилевич

Латыпов Артур Шамилевич – врач генетик высшей квалификационной категории.
После окончания в 1976 году лечебного факультета Казанского государственного медицинского института в течение многих работал сначала врачом кабинета медицинской генетики, затем заведующим медико-генетическим центром Республиканской больницы Татарстана, главным специалистом министерства здравоохранения Республики Татарстан, преподавателем кафедр Казанского медуниверситета.
Автор более 20 научных работ по проблемам репродукционной и биохимической генетики, участник многих отечественных и международных съездов и конференций по проблемам медицинской генетики. Внедрил в практическую работу центра методы массового скрининга беременных и новорожденных на наследственные заболевания, провел тысячи инвазивных процедур при подозрении на наследственные заболевания плода на разных сроках беременности.
С 2012 года работает на кафедре медицинской генетики с курсом пренатальной диагностики Российской академии последипломного образования.
Область научных интересов – метаболические болезни у детей, дородовая диагностика.
Время приема: СР 12-15, СБ 10-14Прием врачей осуществляется по предварительной записи.
Врач-генетик
Габелко
Денис Игоревич

В 2009 году закончил лечебный факультет КГМУ им. С. В. Курашова (специальность «Лечебное дело»).
Интернатура в Санкт-Петербургской медицинской академии последипломного образования Федерального агентства по здравоохранению и социальному развитию (специальность «Генетика»).
Интернатура по терапии. Первичная переподготовка по специальности «Ультразвуковая диагностика». С 2016 года является сотрудником кафедры кафедры фундаментальных основ клинической медицины института фундаментальной медицины и биологии.
Сфера профессиональных интересов: пренатальная диагностика, применение современных скрининговых и диагностических методов для выявления генетической патологии плода. Определение риска повторного возникновения наследственных болезней в семье.
Участник научно-практических конференций по генетике и акушерству и гинекологии.
Стаж работы 5 лет.
Консультация по предварительной записиПрием врачей осуществляется по предварительной записи.
Врач-генетик
Гришина
Кристина Александровна

Окончила в 2015 году Московский Государственный Медико-Стоматологический Университет по специальности
«Лечебное дело». В том же году поступила в ординатуру по специальности 30.08.30 «Генетика» в ФГБНУ «Медико-генетический научный центр».
Принята на работу в лабораторию молекулярной генетики сложно наследуемых заболеваний (заведующий – д.б.н. Карпухин А.В.) в марте 2015 года на
должность лаборанта-исследователя. С сентября 2015 года переведена на должность научного сотрудника. Является автором и соавтором более 10 статей и
тезисов по клинической генетике, онкогенетике и молекулярной онкологии в российских и зарубежных журналах. Постоянный участник конференций по медицинской генетике.
Область научно-практических интересов: медико-генетическое консультирование больных с наследственной синдромальной и мультифакториальной патологией.
Консультация врача-генетика позволяет ответить на вопросы:
являются ли симптомы у ребенка признаками наследственного заболевания
какое исследование необходимо для выявления причины
определение точного прогноза
рекомендации по проведению и оценка результатов пренатальной диагностики
все, что нужно знать при планировании семьи
консультация при планировании ЭКО
выездные и онлайн консультации
Врач-генетик
Горгишели
Кетеван Важаевна

Является выпускницей медико-биологического факультета Российского Национального Исследовательского Медицинского Университета имени Н.И. Пирогова 2015 года, защитила дипломную работу на тему «Клинико-морфологическая корреляция витальных показателей состояния организма и морфофункциональных характеристик мононуклеаров крови при тяжелых отравлениях». Окончила клиническую ординатуру по специальности «Генетика» на кафедре молекулярной и клеточной генетики вышеупомянутого университета.
ринимала участие в научно-практической школе "Инновационные генетические технологии для врачей: применение в клинической практике", конференции Европейского общества генетики человека (ESHG) и других конференциях, посвященных генетике человека.
Проводит медико-генетическое консультирование семей с предположительно наследственной или врожденной патологией, включая моногенные заболевания и хромосомные аномалии, определяет показания к проведению лабораторных генетических исследований, проводит интерпретацию полученных результатов ДНК-диагностики. Консультирует беременных по вопросам пренатальной диагностики с целью предупреждения рождения детей с врождёнными пороками развития.
Врач-генетик, врач акушер-гинеколог, кандидат медицинских наук
Кудрявцева
Елена Владимировна

Врач-генетик, врач акушер-гинеколог, кандидат медицинских наук.
Специалист в области репродуктивного консультирования и наследственной патологии.
Окончила Уральскую государственную медицинскую академию в 2005 году.
Ординатура по специальности «Акушерство и гинекология»
Интернатура по специальности «Генетика»
Профессиональная переподготовка по специальности «Ультразвуковая диагностика»
Направления деятельности:
- Бесплодие и невынашивание беременности Василиса Юрьевна

Является выпускницей Нижегородской государственной медицинской академии, лечебного факультета (специальность «Лечебное дело»). Окончила клиническую ординатуру ФБГНУ «МГНЦ» по специальности «Генетика». В 2014 году проходила стажировку в клинике материнства и детства (IRCCS materno infantile Burlo Garofolo, Trieste, Italy).
С 2016 года работает на должности врача-консультанта в ООО «Геномед».
Регулярно участвует в научно-практических конференциях по генетике.
Основные направления деятельности: Консультирование по вопросам клинической и лабораторной диагностики генетических заболеваний и интерпретация результатов. Ведение пациентов и их семей с предположительно наследственной патологией. Консультирование при планировании беременности, а также при наступившей беременности по вопросам пренатальной диагностики с целью предупреждения рождения детей с врожденной патологией.
В период с 2013 г. по 2014 г. работала в должности младшего научного сотрудника лаборатории молекулярной онкологии Ростовского научно-исследовательского онкологического института.
В 2013 г. - повышение квалификации «Актуальные вопросы клинической генетики», ГБОУ ВПО Рост ГМУ Минздрава России.
В 2014 г. - повышение квалификации «Применение метода ПЦР в реальном времени для генодиагностики соматических мутаций», ФБУН «Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора».
С 2014 г. – врач-генетик лаборатории медицинской генетики Ростовского государственного медицинского университета.
В 2015 г. успешно подтвердила квалификацию «Medical Laboratory Scientist». Является действующим членом «Australian Institute of Medical Scientist».
В 2017 г. - повышение квалификации «Интерпретация результатов Генетических исследований у больных с наследственными заболеваниями», НОЧУДПО «Учебный центр по непрерывному медицинскому и фармацевтическому образованию»; «Актуальные вопросы клинической лабораторной диагностики и лабораторной генетики», ФБОУ ВО РостГМУ Минздрава России; повышение квалификации «BRCA Liverpool Genetic Counselling Course», Liverpool University.
Регулярно участвует в научных конференциях, является автором и соавтором более 20 научных публикаций в отечественных и зарубежных изданиях.
Основное направление деятельности: клинико-лабораторная интерпретация результатов ДНК-диагностики, хромосомного микроматричного анализа, NGS.
Сфера интересов: применение в клинической практике новейших полногеномных методов диагностики, онкогенетика.